Генетическое картирование генов заболеваний человека примеры. Картирование геномов
Картирование генов - определение положения данного гена на какой-либо хромосоме относительно других генов. Используют три основные группы методов картирования генов – физическое (определение с помощью рестрикционных карт, электронной микроскопии и некоторых вариантов электрофореза межгенных расстояний – в нуклеотидах), генетическое (определение частот рекомбинаций между генами, в частности, в семейном анализе и др.) и цитогенетическое (гибридизации in situ, получение монохромосомных клеточных гибридов, делеционный метод и др.). В генетике человека приняты 4 степени надежности локализации данного гена – подтвержденная (установлена в двух и более независимых лабораториях или на материале двух и более независимых тест - объектов), предварительная (1 лаборатория или 1 анализируемая семья), противоречивая (несовпадение данных разных исследователей), сомнительная (не уточненные окончательно данные одной лаборатории).
Генетическое картирование предполагает определение расстояний по частоте рекомбинаций между генами. Физическое картирование использует некоторые методы молекулярной генетики для определения расстояния в нуклеотидах. Генетическое картирование - это определение группы сцепления и положения картируемого гена относительно других генов данной хромосомы.
Чем больше генов известно у данного вида, тем точнее результаты этой процедуры. Как правило, число генов в группах сцепления зависит от линейных размеров соответствующих хромосом. Однако, протяженные области конститутивного гетерохроматина (в районе центромеры и теломерных участков) практически не содержат генов и, таким образом, нарушают эту зависимость.
На первом этапе картирования определяют принадлежность гена к той или иной группе сцепления. Как известно, у D. melanogaster вдиплоидном наборе четыре пары хромосом: первая пара - половые хромосомы (XX - у самок, XY - у самцов), вторая, третья и четвертая - аутосомы. Число генов в Y-хромосоме самцов очень мало. Для локализации вновь возникшей мутации необходимо располагать набором маркерных генов для каждой хромосомы. Картирование мутации основывается на анализе ее сцепления с этими маркерами. Например, если интересующая нас мутация наследуется независимо от маркеров второй хромосомы, делается вывод о ее принадлежности к другой группе сцепления.
О значении картирования генов, и в первую очередь генов человека, говорит создание Международной программы "Геном человека ", которая ставит перед собой грандиозную задачу картировать все гены человека и секвенировать полностью всю ДНК генома. Программа разрабатывается в сотнях лабораторий во многих странах мира. Используются методы молекулярной биологии, цитогенетики и генетики соматических клеток. Разработаны критерии, определяющие достоверность картирования. Определены различные уровни достоверности локализации гена.
Важным вкладом в развитие генетики стала хромосомная теория наследственности, разработанная, прежде всего, благодаря усилиям американского генетика Томаса Ханта Моргана и его учеников и сотрудников, избравших объектом своих исследований плодовую мушку Drosophila melanogaster . Изучение закономерностей сцепленного наследования позволило путем анализа результатов скрещиваний составить карты расположения генов в «группах сцепления» и сопоставить группы сцепления с хромосомами (1910-1913 гг.).
Slide 1
Выполнила: Голубева Ю.В. 410гр
Slide 2
Одна из основных задач современной генетики
заключается в выяснении природы комплексных
признаков, к которым в частности относятся
многие распространенные болезни человека и
характеристики продуктивности
сельскохозяйственных животных. Стартовым
этапом на пути решения этого вопроса
является
Slide 3
Картирование генов -
Slide 4
Стратегические подходы
к картированию геномов
Slide 5
Стратегия прямой
генетики
Различия во времени появления,
необходимой методической базой и
спектре возможностей. Функция гена
известна хотя бы частично.
Slide 6
Функциональное
картирование
Основа - наличие некоторой информации о
биохимическом полиморфизме, лежащем в
основе того или иного наследственного
признака.
начинается с выделения в чистом виде
белкового продукта гена.
к нему по аминокислотной последовательности
подбирают вырожденные праймеры
проводят ПЦР-скрининг
Slide 7
Большинство генов, функция которых
была известна, уже клонированы и
локализованы.
Slide 8
Для большинства генов, которые
были локализованы, характерны
структурные аномалии (как
правило, это гены, ответственные за
наследственные заболевания
человека), что существенно
облегчает заключительную стадию
поиска гена - выделение и
локализацию гена.
Slide 9
Кандидатное
картирование
информация о функциональном
изменении недостаточно полна, чтобы
точно указать ген
Информации достаточна для того,
чтобы выдвинуть предположения о
возможных кандидатах либо по их
функции, либо по положению на
хромосоме
Slide 10
Общее:
при функциональном, и при
кандидатном подходе клонирование
гена, как правило, предшествует его
точной локализации в геноме
локализовать ген означает пройти путь
от его функции к локализации на
хромосоме (позиции)
Slide 11
Стратегия обратной
генетики
От хромосомной карты к функции
гена. Возникло благодаря появление в
конце 80-х годов множества
высокополиморфных ДНК-маркеров
Slide 12
Позиционное
картирование
локализация гена при отсутствии всякой
функциональной информации о нем
место гена на карте устанавливают по
результатам анализа его сцепления с
ранее локализованными генетическими
маркерами, далее исследуется уже
область генома рядом с маркером
Slide 13
Генетический маркёр
(genetic marker)
Ген, детерминирующий
отчетливо выраженный
фенотипический признак,
используемый для
генетического картирования
и индивидуальной
идентификации организмов
или клеток. Также в качестве
генетических маркеров
могут служить целые
(маркерные) хромосомы.
Slide 14
Минусы
ограничением позиционного
подхода является низкая
разрешающая способность
генетических карт - интервал между
двумя соседними маркерами, в
котором локализован ген, может
оказаться слишком велик и
недоступен физическому
картированию.
Slide 15
Картирование генов –
виды
Физическое картирование
Генетическое картирование
Цитогенетическое(цитологическое)
картирование
Slide 16
Физическое
картирование
обширная группа методов, позволяющая строить
карты генома (обычно их называют физическими)
высокого уровня разрешения и определять
расстояния между локализуемыми нуклеотидными
последовательностями с точностью от нескольких
десятков тысяч п.н. до одной нуклеотидной пары.
Пример: картирование
генов с помощью
хромосомных мутаций
Slide 17
Типы физического
картирования
рестрикционное картирование
RH-картирование
клонирование в YAC (от англ. yeast artificial
chromosome)
BAC (от англ. bacterial artificial
chromosome) в космидах, плазмидах и
других векторах и контиг-картирование на
их основе
секвенирование ДНК
Slide 18
В том случае, когда известна
последовательность ДНК интересующего
локуса, эту последовательность можно
использовать для гибридизации с
хромосомами in situ, и место гибридизации
будет однозначно указывать на локализацию
локуса в определенном районе определенной
же хромосомы
Slide 19
Генетическое
картирование
картирование, основанное
на методах классической
генетики - определении
групп сцепления, частоты
рекомбинации и
построении генетических
карт, где единицей
измерения служат
проценты рекомбинации
Slide 20
Первый ген человека
был локализован на
Х-хромосоме в 1911
г.
Первый аутосомный
ген - только в 1968 г
Slide 21
Генетическая карта
(genetic map
Схема взаимного
расположения генов на
хромосоме (в группе
сцепления) и их
распределения по
разным хромосомам,
как правило,
включающая данные об
относительном
удалении генов друг от
друга (генетические
расстояния).
Slide 22
Генетическая карта
американской норки
включает 127 генов
(черный текст) и 39
микросателлитных
последовательностей
(красным текст).
Разным цветом
выделены районы
хромосом норки
гомологичные
хромосомным.
Slide 23
Преимущества
большое число консервативных групп
сцепления
создание банков клеточных культур
для локализации вновь возникшей
мутации к настоящему моменту есть
набор маркерных генов для каждой
хромосомы.
Slide 24
Построение
генетической карты
Шаг 1: формирование групп
сцепления генов и исследование их
взаимного расположения(Скрещивания
проводятся до тех пор, пока не удастся выявить
сцепленное наследование анализируемой
мутации с маркерными мутациями какой-либо
хромосомы)
Шаг 2: подсчитывание расстояния
между исследуемым геном и уже
известными маркерными генами
Slide 25
Единицы измерения
Генетическое расстояние между линейно
расположенными генами, выраженно в процентах
рекомбинации -
Два гена на хромосоме
находятся на расстоянии 1
сМ, если вероятность
рекомбинации между ними
в процессе мейоза
составляет 1%.
Классический пример Моргана –
расстояния между генами
дрозофилы
Slide 26
4 степени надежности
локализации данного гена
подтвержденная (установлена в двух и
более независимых лабораториях или на
материале двух и более независимых тестобъектов),
предварительная (1 лаборатория или 1
анализируемая семья),
противоречивая (несовпадение данных
разных исследователей),
сомнительная (не уточненные
окончательно данные одной лаборатории)
Slide 27
Минусы:
частота рекомбинации в
разных точках генома
различна, и расстояние
может существенно
варьировать
Необходим
тщательный
анализ
родословной
(если
картируется ген
заболевания)
в результате карты
сцеплений не отражают
реальных физических
расстояний между
маркерами и генами
на хромосомах.
Slide 28
Цитогенетическое
картирование
осуществляется с применением
методов цитогенетики, когда для
локализации каких-либо
нуклеотидных
последовательностей и
определения их взаимного
расположения используются
цитологические препараты
Slide 29
Цитологические карты
Метод цитологических карт основан на
использовании хромосомных перестроек –
перекрывающихся делеций.
При облучении и действии других
мутагенов в хромосомах часто
наблюдаются потери (делеции)
или вставки (дупликации)
небольших фрагментов,
сравнимых по величине с одним
или несколькими локусами.
Slide 30
Принципы:
Используются гетерозиготы по хромосомам, одна из которых
будет нести группу следующих друг за другом доминантных
аллелей, а гомологичная ей - группу рецессивных аллелей тех же
генов.
Если в хромосоме с доминантными генами произошла утрата
отдельных генов, например DE, то у гетерозиготы ABC/abcde будут
проявляться рецессивные признаки de. На этом принципе основан
метод перекрывающихся делеции, используемый при построении
цитологических карт.
Slide 31
Методы
дифференциального
окрашивания позволяют
идентифицировать на
препарате как отдельную
хромосому, так и любой
участок хромосомы
Разработанный на дрозофиле
специальный метод
перекрывающихся делеций был
использован для
цитологического картирования
генов у представителей многих
видов.
Slide 32
Хромосомные комплексы китайского хомячка
(А), мыши (Б) и их соматического гибрида (В)
Slide 33
Сравнение генетических и
цитологических карт хромосом
показывает их соответствие:
чем больший процент
кроссинговера разделяет пару
генов, тем больше и физическое
расстояние между ними.
Slide 34
Запись локализации
гена
Согласно официально утвержденной номенклатуре
(ISCN,1978), каждая хромосома человека после
дифференциальной окраски может быть разделена на
, нумерация которых начинается от
центромеры вверх (
), либо вниз
).
в каждом
участке тоже нумеруются в аналогичном порядке. Крупные
полосы разделяются на более мелкие
Slide 35
Slide 36
Алгоритм решения
задач на картирование
генов
Slide 37
Пример:
Составьте карту хромосомы,
содержащую гены, если
частота кроссинговера между
генами и равна 2,5%, и -
3,7%, и -6%, и - 2,8%, и -
6,2%, и - 15%, и - 8,8%
Slide 38
Slide 39
Используемая
литература
Э. Р. Рахманалиев, Е. А. Климов, Г. Е. Сулимова МЕТОДЫ
КАРТИРОВАНИЯ ГЕНОМОВ МЛЕКОПИТАЮЩИХ.
КАРТИРОВАНИЕ С ИСПОЛЬЗОВАНИЕМ РАДИАЦИОННЫХ
ГИБРИДОВ (RH КАРТИРОВАНИЕ)
Аксенович Т.И. Проблемы картирования QTL (Институт
цитологии и генетики СО РАН, Новосибирск)
Мяндлина Г.И. Молекулярные основы медицинской
генетики(кафедра биологии и общей генетики,
медицинского факультета РУДН)
В.И. Иванов Генетика Учебник для вузов, 2006
Картирование генома человека
Нам незачем богов напрасно беспокоить -
Есть внутренности жертв, чтоб о войне гадать,
Рабы, чтобы молчать, и камни, чтобы строить!
Осип Мандельштам, «Природа - тот же Рим…»
Генетика - молодая наука. Эволюция видов была по-настоящему открыта лишь в конце 50-х годов XIX века. В 1866 году австрийский монах Грегор Мендель опубликовал результаты своих опытов по опылению гороха. Вплоть до конца века на его открытие никто не обратил внимания. И Гальтон, к примеру, так никогда и не узнал о них. Даже механизм оплодотворения - слияние ядер мужских и женских половых клеток - был открыт лишь в 1875 году. В 1888 г. в ядрах клеток были обнаружены тельца, названные хромосомами, а в 1909-м менделевские факторы наследования получили наименование генов. Первое искусственное оплодотворение (у кролика, а затем у обезьян) было произведено в 1934 году; и, наконец, в 1953-м было совершено фундаментальное открытие - установлена двойная спиральная структура ДНК. Как видим, все это произошло совсем недавно, так что ранние евгеники в общем-то были весьма мало осведомлены о технике своего дела.
Картирование генома человека находится все еще на ранней стадии. То, что мы знаем, - это малая крупица по сравнению с тем, чего мы не знаем. Существует три миллиарда нуклеотидных последовательностей, образующих от двадцати шести до тридцати восьми тысяч генов, которыми непосредственно кодируются белки. А вот как взаимодействуют гены и производимые ими белки, до сих пор плохо понятно.
Впрочем, роль генов в человеческом обществе довольно быстро осознается. В 1998 году Дайана Пол (Массачусетский университет) напомнила о том, что еще четырнадцать лет тому назад она назвала
«биологически детерминистской» точку зрения, согласно которой на различия в интеллекте и темпераменте влияют гены - используя эти термины так, словно их значение было конкретизировано. Сегодня их использование было бы спорным, так как эти ярлыки как бы ставят данную точку зрения под вопрос, в то время, как она широко принята и учеными, и общественностью» .
Как бы то ни было, наши знания пополняются буквально с каждым днем, и уже в самом недалеком будущем мы сумеем с большой точностью анализировать генетический груз, который мы навязываем будущим поколениям.
Из книги Новейшая книга фактов. Том 1 [Астрономия и астрофизика. География и другие науки о Земле. Биология и медицина] автора Из книги Геном человека: Энциклопедия, написанная четырьмя буквами автора Из книги Геном человека [Энциклопедия, написанная четырьмя буквами] автора Тарантул Вячеслав Залманович Из книги Новейшая книга фактов. Том 1. Астрономия и астрофизика. География и другие науки о Земле. Биология и медицина автора Кондрашов Анатолий Павлович Из книги Расшифрованная жизнь [Мой геном, моя жизнь] автора Вентер Крейг Из книги Биологическая химия автора Лелевич Владимир Валерьянович Из книги автора Из книги автораЧАСТЬ I. СТРУКТУРА ГЕНОМА ЧЕЛОВЕКА ЧТО ТАКОЕ ГЕНОМ? Вопросы вечны, ответы обусловлены временем. Е. Чаргафф В диалоге с жизнью важен не ее вопрос, а наш ответ. М. И. Цветаева С самого начала определимся, что мы здесь будем подразумевать под словом геном. Сам этот термин
Из книги автораАнализ суммарной ДНК - новые сведения о структуре генома человека На первом этапе непосредственного исследования структуры генома человека, когда еще не существовала методология генной инженерии, для изучения ДНК применяли традиционные физико-химические методы. В
Из книги автора Из книги автораЧАСТЬ II. ФУНКЦИЯ ГЕНОМА ЧЕЛОВЕКА КОРОЛЕВА УМЕРЛА - ДА ЗДРАВСТВУЕТ КОРОЛЕВА! То, что мы знаем, - ограниченно, а то, чего мы не знаем, - бесконечно. П. Лаплас Наука всегда оказывается не права. Она никогда не решит вопроса, не поставив при этом десятка новых. Б. Шоу Итак,
Из книги автораЧем полезен компьютер для изучения генома человека? Без компьютерных биоинформационных технологий (геноинформатики, или, в более широком смысле, - биоинформатики) развитие геномных исследований вообще едва ли было бы возможным. Даже трудно себе представить, как бы
Из книги автораЧАСТЬ III. ПРОИСХОЖДЕНИЕ И ЭВОЛЮЦИЯ ГЕНОМА ЧЕЛОВЕКА
Из книги автораНасколько геном человека отличается от генома шимпанзе? Геномом называют совокупность генов, содержащихся в гаплоидном (одинарном) наборе хромосом данного организма. Геном является характеристикой не отдельной особи, а вида организмов. В феврале 2001 года в американских
Из книги автораГлава 11 Расшифровка генома человека Что вы скажете, когда, карабкаясь из последних сил к вершине горы, на которой еще никто не бывал, вдруг увидите человека, взбирающегося вверх параллельной тропой? В науке сотрудничество всегда гораздо плодотворнее,
Вскоре после переоткрытия законов Менделя немецкий цитолог Теодор Бовери (1902) представил доказательства в пользу участия хромосом в процессах наследственной передачи, показав, что нормальное развитие морского ежа возможно только при наличии всех хромосом. В это же время (1903 г.) американский цитолог Уильям Сэттон обратил внимание на параллелизм в поведении хромосом в мейозе и гипотетических факторов наследственности, существование которых предсказал еще сам Мендель.
Уильям Сэттон предположил, что в одной хромосоме может находиться несколько генов. В этом случае должно наблюдаться сцепленное наследование признаков, т.е. несколько разных признаков могут наследоваться так, как будто они контролируются одним геном. В 1906 г. У. Бэтсон и Р. Пеннет обнаружили сцепленное наследование у душистого горошка. Они изучали совместное наследование: окраски цветков (пурпурная или красная) и формы пыльцевых зерен (удлиненная или округлая). При скрещивании дигетерозигот в их потомстве наблюдалось расщепление 11,1:0,9:0,9:3,1 вместо ожидаемого 9:3:3:1. Создавалось впечатление, что факторы окраски и формы пыльцы имеют тенденцию при рекомбинации задатков оставаться вместе. Это явление авторы назвали «взаимным притяжением факторов», но природу его им выяснить не удалось.
Дальнейшее изучение хромосом как носителей информации происходило в первые десятилетия ХХ века в лаборатории Томаса Ханта Моргана (США) и его сотрудников (А. Стёртеванта, К. Бриджеса, Г. Мёллера). В качестве основного объекта исследований Морган использовал плодовую мушку дрозофилу (Drosophila melanogaster), которая оказалась очень удобным модельным объектом:
– Во-первых, эта мушка легко культивируется в лабораторных условиях.
– Во-вторых, она характеризуется малым числом хромосом 2 n = 8).
– В-третьих, в слюнных железах личинок дрозофилы имеются гигантские (политенные) хромосомы, удобные для прямого наблюдения.
– И, наконец, дрозофила отличается высокой изменчивостью морфологических признаков.
На основании экспериментов с плодовой мушкой дрозофилой Морганом и его учениками была разработана хромосомная теория наследственности.
Основные положения хромосомной теории наследственности:
1. Ген – это элементарный наследственный фактор (термин «элементарный» означает «неделимый без потери качества»). Ген представляет собой участок хромосомы, отвечающий за развитие определенного признака. Иначе говоря, гены локализованы в хромосомах.
2. В одной хромосоме могут содержаться тысячи генов, расположенных линейно (подобно бусинкам на нитке). Эти гены образуют группы сцепления. Число групп сцепления равно числу хромосом в гаплоидном наборе. Совокупность аллелей в одной хромосоме называется гаплотип. Примеры гаплотипов: ABCD (только доминантные аллели), abcd (только рецессивные аллели), AbCd (различные комбинации доминантных и рецессивных аллелей).
3. Если гены сцеплены между собой, то возникает эффект и сцепленного наследования признаков, т.е. несколько признаков наследуются так, как будто они контролируются одним геном. При сцепленном наследовании в череде поколений сохраняются исходные сочетания признаков.
4. Сцепление генов не абсолютно: в большинстве случаев гомологичные хромосомы обмениваются аллелями в результате перекреста (кроссинговера) в профазе первого деления мейоза. В результате кроссинговера образуются кроссоверные хромосомы (возникают новые гаплотипы, т.е. новые сочетания аллелей.). С участием кроссоверных хромосом в последующих поколениях у кроссоверных особей должны появляться новые сочетания признаков.
5. Вероятность появления новых сочетаний признаков вследствие кроссинговера прямо пропорциональна физическому расстоянию между генами. Это позволяет определять относительное расстояние между генами и строить генетические (кроссоверные) карты разных видов организмов.
КРОССИНГОВЕР
Кроссинговер (от англ. crossing-over – перекрёст) – это процесс обмена гомологичными участками гомологичных хромосом (хроматид).
Обычно кроссинговер происходит в мейозе I.
При кроссинговере происходит обмен генетическим материалом (аллелями) между хромосомами, и тогда происходит рекомбинация – появление новых сочетаний аллелей, например, AB + ab → Ab + aB.
Механизм кроссинговера «разрыв–воссоединение»
Согласно теории Янссенса–Дарлингтона, кроссинговер происходит в профазе мейоза. Гомологичные хромосомы с хроматидами АВ и ab образуют биваленты. В одной из хроматид в первой хромосоме происходит разрыв на участке А–В, тогда в прилежащей хроматиде второй хромосомы происходит разрыв на участке a–b. Клетка стремится исправить повреждение с помощью ферментов репарации–рекомбинации и присоединить фрагменты хроматид. Однако при этом возможно присоединение крест–накрест (кроссинговер), и образуются рекомбинантные хроматиды Ab и аВ. В анафазе первого деления мейоза происходит расхождение двухроматидных хромосом, а во втором делении – расхождение хроматид (однохроматидных хромосом). Хроматиды, которые не участвовали в кроссинговере, сохраняют исходные сочетания аллелей. Такие хроматиды (однохроматидные хромосомы) называются некроссоверными; с их участием разовьются некроссоверные гаметы, зиготы и особи. Рекомбинантные хроматиды, которые образовались в ходе кроссинговера, несут новые сочетания аллелей. Такие хроматиды (однохроматидные хромосомы) называются кроссоверными, с их участием разовьются кроссоверные гаметы, зиготы и особи. Таким образом, вследствие кроссинговера происходит рекомбинация – появление новых сочетаний наследственных задатков в хромосомах.
Согласно другим теориям, кроссинговер связан с репликацией ДНК: или в пахитене мейоза, или в интерфазе. В частности, возможна смена матрицы в вилке репликации.
Генетические (кроссоверные) карты
Алфред Стёртевант (сотрудник Моргана) предположил, что частота кроссинговера на участке между генами, локализованными в одной хромосоме, может служить мерой расстояния между генами. Иными словами, частота кроссинговера, выражаемая отношением числа кроссоверных особей к общему числу особей, прямо пропорциональна расстоянию между генами. Тогда можно использовать частоту кроссинговера для того, чтобы определять взаимное расположение генов и расстояние между генами. Единицей расстояния между генами служит 1 % кроссинговера; в честь Моргана эта единица называется морганидой (М).
На основании генетического картирования составляются генетические карты – схемы, отражающие положение генов в хромосомах относительно других генов. На генетических картах крайнему гену (т.е. наиболее удаленному от центромеры) соответствует нулевая (исходная) точка. Удаленность какого-либо гена от нулевой точки обозначается в морганидах.
Построение генетических карт различных организмов имеет большое значение в здравоохранении, селекции и экологии. При изучении признаков человека (и в частности, генетических заболеваний) важно знать, какой именно ген определяет рассматриваемый признак. Эти знания позволяют составлять прогнозы при медико-генетическом консультировании, при разработке методов лечения генетических заболевания, в т.ч. и для коррекции генома. Знание генетических карт культурных растений и домашних животных позволяет планировать селекционный процесс, что способствует получению надежных результатов в краткие сроки. Построение генетических карт дикорастущих растений и диких животных важно и сточки зрения экологии. В частности, исследователь получает возможность изучать не просто фенотипические признаки организмов, а конкретные, генетически обусловленные признаки.
Двойной и множественный кроссинговер
Морган предположил, что кроссинговер между двумя генами может происходить не только в одной, но и в двух и даже большем числе точек. Четное число перекрестов между двумя генами, в конечном счете, не приводит к их перемещению из одной гомологичной хромосомы в другую, поэтому число кроссинговеров и, следовательно, расстояние между этими генами, определенное в эксперименте, снижаются. Обычно это относится к достаточно далеко расположенным друг от друга генам. Естественно, что вероятность двойного перекреста всегда меньше вероятности одинарного. В принципе она будет равна произведению вероятности двух единичных актов рекомбинации. Например, если одиночный перекрест будет происходить с частотой 0,2, то двойной – с частотой 0,2 × 0,2 = 0,04. В дальнейшем, наряду с двойным кроссинговером, было открыто и явление множественного кроссинговера: гомологичные хроматиды могут обмениваться участками в трех, четырех и более точках.
Интерференция – это подавление кроссинговера на участках, непосредственно прилегающих к точке происшедшего обмена.
Рассмотрим пример, описанный в одной из ранних работ Моргана. Он исследовал частоту кроссинговера между генами w (white – белые глаза), у (yellow – желтое тело) и m (miniature – маленькие крылья), локализованными в Х-хромосоме D. melanogaster. Расстояние между генами w и у в процентах кроссинговера составило 1,3, а между генами у и m – 32,6. Если два акта кроссинговера наблюдаются случайно, то ожидаемая частота двойного кроссинговера должна быть равна произведению частот кроссинговера между генами у и w и генами w и m. Другими словами, частота двойных кроссинговеров будет 0,43%. В действительности в опыте был обнаружен лишь один двойной кроссинговер на 2205 мух, т. е. 0,045%. Ученик Моргана Г. Меллер предложил определять интенсивность интерференции количественно, путем деления фактически наблюдаемой частоты двойного кроссинговера на теоретически ожидаемую (при отсутствии интерференции) частоту. Он назвал этот показатель коэффициентом коинциденции, т. е. совпадения. Меллер показал, что в Х-хромосоме дрозофилы интерференция особенно велика на небольших расстояниях; с увеличением интервала между генами интенсивность ее уменьшается и на расстоянии около 40 морганид и более коэффициент коинциденции достигает 1 (максимального своего значения).
Цитологическое доказательство кроссинговера
Прямые цитологические свидетельства обмена частей хромосом во время кроссинговера были получены в начале 30-х годов у дрозофилы и кукурузы.
Рассмотрим опыт Штерна, проведенный на D. melanogaster. Обычно две гомологичные хромосомы морфологически неразличимы. Штерн исследовал Х-хромосомы, которые имели морфологические различия и, следовательно, были гомологичны не полностью. Однако гомология между этими хромосомами сохранялась на большей части их длины, что позволяло им нормально спариваться и сегрегировать в мейозе (то есть нормально распределяться по дочерним клеткам). Одна из Х-хромосом самки в результате транслокации, т. е. перемещения фрагмента Y-хромосомы, приобрела Г-образную форму. Вторая Х-хромосома была короче нормальной, так как часть ее была перенесена на IV хромосому. Были получены самки, гетерозиготные по указанным двум, морфологически различным, Х-хромосомам, а также гетерозиготные по двум генам, локализованным в Х-хромосоме: Bar (В) и carnation (cr). Ген Bar – это полудоминантный ген, влияющий на количество фасеток и, следовательно, форму глаза (мутанты с аллелем В имеют полосковидные глаза). Ген cr контролирует окраску глаз (аллель cr+ обусловливает нормальную окраску глаз, а аллель cr – окраску глаз цвета красной гвоздики). Г-образная Х-хромосома несла аллели дикого типа В+ и cr+, укороченная хромосома – мутантные аллели В и cr. Самки указанного генотипа скрещивались с самцами, имевшими морфологически нормальную Х-хромосому с аллелями cr и В+. В потомстве самок было два класса мух с некроссоверными хромосомами (crB / crB+ и cr+B+ / crB+) и два класса мух, фенотип которых соответствовал кроссоверам (crB+ / crB+ и cr+B / crB+). Цитологическое исследование показало, что у кроссоверных особей произошел обмен участками Х-хромосом, и, соответственно, изменилась их форма. Все четыре класса самок имели по одной нормальной, т. е. палочковидной, хромосоме, полученной от отца. Кроссоверные самки содержали в своем кариотипе преобразованные в результате кроссинговера Х-хромосомы – длинную палочковидную или двуплечую с короткими плечами. Эти опыты, так же как и одновременно полученные аналогичные результаты на кукурузе, подтвердили гипотезу Моргана и его сотрудников о том, что кроссинговер представляет собой обмен участками гомологичных хромосом и что гены действительно локализованы в хромосомах.
Соматический (митотический) кроссинговер.
В соматических клетках иногда происходят обмены между хроматидами гомологичных хромосом, в результате которых наблюдается комбинативная изменчивость, подобная той, которая регулярно генерируется мейозом. Нередко, особенно у дрозофилы и низших эукариот, гомологичные хромосомы синаптируют в митозе. Одна из аутосомно-рецессивных мутаций человека, в гомозиготном состоянии приводящая к тяжелому заболеванию, известному под названием синдром Блюма, сопровождается цитологической картиной, напоминающей синапс гомологов и даже образование хиазм.
Доказательство митотического кроссинговера было получено на дрозофиле при анализе изменчивости признаков, определяемых генами у (yellow – желтое тело) и sn (singed – опаленные щетинки), которые находятся в Х-хромосоме. Самка с генотипом y sn+ / y+sn гетерозиготна по генам у и sn, и поэтому в отсутствие митотического кроссинговера ее фенотип будет нормальным. Однако если кроссинговер произошел на стадии четырех хроматид между хроматидами разных гомологов (но не между сестринскими хроматидами), причем место обмена находится между геном sn и центромерой, то образуются клетки с генотипами y sn+ / y+ sn+ и y+ sn / y+ sn. В этом случае на сером теле мухи с нормальными щетинками появятся близнецовые мозаичные пятна, одно из которых будет желтого цвета с нормальными щетинками, а другое - серого цвета с опаленными щетинками. Для этого необходимо, чтобы после кроссинговера обе хромосомы (бывшие хроматиды каждого из гомологов) y+ sn отошли к одному полюсу клетки, а хромосомы y sn+ – к другому. Потомки дочерних клеток, размножившись на стадии куколки, и приведут к появлению мозаичных пятен. Таким образом, мозаичные пятна образуются тогда, когда рядом расположены две группы (точнее, два клона) клеток, фенотипически отличающиеся друг от друга и от клеток остальных тканей данной особи.
Неравный кроссинговер
Это явление было детально изучено на примере гена Bar (В – полосковидные глаза), локализованного в Х-хромосоме D. melanogaster. Неравный кроссинговер связан с дупликацией какого-либо участка в одном из гомологов и с утратой его в другом гомологе. Обнаружено, что ген В может присутствовать в виде тандемных, т. е. следующих друг за другом, повторов, состоящих из двух и даже трех копий. Цитологический анализ подтвердил предположение о том, что неравный кроссинговер может вести к тандемным дупликациям. В области, соответствующей локализации гена В, на препаратах политенных хромосом отмечено увеличение числа дисков, пропорциональное дозе гена. Предполагается, что в эволюции неравный кроссинговер стимулирует создание тандемных дупликаций различных последовательностей и использование их в качестве сырого генетического материала для формирования новых генов и новых регуляционных систем.
Регуляция кроссинговера
Кроссинговер – это сложный физиолого-биохимический процесс, который находится под генетическим контролем клетки и подвержен влиянию факторов внешней среды. Поэтому в реальном эксперименте о частоте кроссинговера можно говорить, имея в виду все те условия, в которых она была определена. Кроссинговер практически отсутствует между гетероморфными Х- и Y-хромосомами. Если бы он происходил, то хромосомный механизм определения пола постоянно разрушался бы. Блокирование кроссинговера между этими хромосомами связано не только с различием в их величине (оно наблюдается не всегда), но и обусловлено Y-специфичными нуклеотидными последовательностями. Обязательное условие синапса хромосом (или их участков) - гомология нуклеотидных последовательностей.
Для абсолютного большинства высших эукариот характерна примерно одинаковая частота кроссинговера как у гомогаметного, так и гетерогаметного полов. Однако есть виды, у которых Кроссинговер отсутствует у особей гетерогаметного пола, в то время как у особей гомогаметного пола он протекает нормально. Такая ситуация наблюдается у гетерогаметных самцов дрозофилы и самок шелкопряда. Существенно, что частота митотического кроссинговера у этих видов у самцов и самок практически одинакова, что указывает на различные элементы контроля отдельных этапов генетической рекомбинации в половых и соматических клетках. В гетерохроматических районах, в частности прицентромерных, частота кроссинговера снижена, и поэтому истинное расстояние между генами в этих участках может быть изменено.
Обнаружены гены, выполняющие функции запирателей кроссинговера, но есть также гены, повышающие его частоту. Они иногда могут индуцировать заметное число кроссоверов у самцов дрозофилы. В качестве запирателей кроссинговера могут выступать также хромосомные перестройки, в частности инверсии. Они нарушают нормальную конъюгацию хромосом в зиготене.
Обнаружено, что на частоту кроссинговера влияют возраст организма, а также экзогенные факторы: температура, радиация, концентрация солей, химические мутагены, лекарства, гормоны. При большинстве указанных воздействий частота кроссинговера повышается.
В целом кроссинговер представляет собой один из регулярных генетических процессов, контролируемых многими генами как непосредственно, так и через физиологическое состояние мейотических или митотических клеток. Частота различных типов рекомбинаций (мейотический, митотический кроссинговер и сестринские хроматидные обмены) может служить мерой действия мутагенов, канцерогенов, антибиотиков и др.
Биологическое значение кроссинговера
Благодаря сцепленному наследованию удачные сочетания аллелей оказываются относительно устойчивыми. В результате образуются группы генов, каждая из которых представляет собой как единый суперген, контролирующий несколько признаков. В то же время, в ходе кроссинговера возникают рекомбинации – т.е. новые комбинации аллелей. Таким образом, кроссинговер повышает комбинативную изменчивость организмов.
Эволюционное значение сцепленного наследования. В результате сцепления одна хромосома может содержать как благоприятные аллели (например, А), так и нейтральные или относительно неблагоприятные (например, N). Если некоторый гаплотип (например, AN) повышает приспособленность его носителей за счет наличия благоприятных аллелей A, то в популяции будут накапливаться как благоприятные аллели, так и сцепленные с ними нейтральные или относительно неблагоприятные N.
Пример. Гаплотип AN обладает преимуществом перед гаплотипом “дикого типа» (++) за счет наличия благоприятного аллеля А, и тогда аллель N будет накапливаться в популяции, если он селективно нейтральный или даже относительно неблагоприятный (но его отрицательное влияние на приспособленность компенсируется положительным влиянием аллеля А).
Эволюционное значение кроссинговера. В результате кроссинговера неблагоприятные аллели, первоначально сцепленные с благоприятными, могут переходить в другую хромосому. Тогда возникают новые гаплотипы, не содержащие неблагоприятных аллелей, и эти неблагоприятные аллели элиминируются из популяции.
Пример. Гаплотип Al оказывается неблагоприятным по сравнению с гаплотипом «дикого типа» (++) за счет наличия летального аллеля l. Поэтому аллель А (благоприятный, нейтральный ил несколько снижающий приспособленность) не может проявиться в фенотипе, поскольку данный гаплотип (Al) содержит летальный аллель l. В результате кроссинговера возникают рекомбинантные гаплотипы A+ и +l. Гаплотип +l элиминируется из популяции, а гаплотип A+ фиксируется (даже в том случае, если аллель А несколько снижает приспособленность его носителей).
ДОПОЛНЕНИЯ
Принципы генетического картирования
Алфред Стёртевант (сотрудник Моргана) предположил, что частота кроссинговера на участке между генами, локализованными в одной хромосоме, может служить мерой расстояния между генами. Иными словами, частота кроссинговера, выражаемая отношением числа кроссоверных особей к общему числу особей, прямо пропорциональная расстоянию между генами. Тогда можно использовать частоту кроссинговера для того, чтобы определять взаимное расположение генов и расстояние между генами.
Генетическое картирование – это определение положения какого-либо гена по отношению к двум (как минимум) другим генам. Постоянство процента кроссинговера между определенными генами позволяет локализовать их. Единицей расстояния между генами служит 1 % кроссинговера; в честь Моргана эта единица называется морганидой (М).
На первом этапе картирования необходимо определить принадлежность гена к группе сцепления. Чем больше генов известно у данного вида, тем точнее результаты картирования. Все гены разбивают на группы сцепления. Число групп сцепления соответствует гаплоидному набору хромосом. Например, у D. melanogaster 4 группы сцепления, у кукурузы – 10, у мыши – 20, у человека – 23 группы сцепления. Как правило, число генов в группах сцепления зависит от линейных размеров соответствующих хромосом. Так, у плодовой мушки имеется одна (IV) точечная (при анализе в световом микроскопе) хромосома. Соответственно число генов в ней во много раз меньше, чем в остальных, значительно превосходящих ее по длине. Следует также отметить, что в гетерохроматических районах хромосом генов нет или почти нет, поэтому протяженные области конститутивного гетерохроматина могут несколько изменить пропорциональность числа генов и длины хромосомы.
На основании генетического картирования составляются генетические карты. На генетических картах крайнему гену (т.е. наиболее удаленному от центромеры) соответствует нулевая (исходная) точка. Удаленность какого-либо гена от нулевой точки обозначается в морганидах.
Если хромосомы достаточно длинные, то удаление гена от нулевой точки может превышать 50 М – тогда возникает противоречие между отмеченными на карте расстояниями, превышающими 50%, и постулированным выше положением, согласно которому 50 % кроссоверов, полученных в эксперименте, фактически должны означать отсутствие сцепления, т. e. локализацию генов в разных хромосомах. Это противоречие объясняется тем, что при составлении генетических карт суммируются расстояния между двумя наиболее близкими генами, что превышает экспериментально наблюдаемый процент кроссинговера.
Цитогенетическое картирование
Этот метод основан на использовании хромосомных перестроек. В случае гигантских политенных хромосом он позволяет прямо сопоставлять результаты генетического анализа расстояний между изучаемыми локусами и их взаимного расположения с данными о физических размерах определенных хромосомных областей. При облучении и действии других мутагенов в хромосомах часто наблюдаются выпадения (делеции) или вставки небольших фрагментов, сравнимых по величине с одним или несколькими локусами. Например, можно использовать гетерозиготы по хромосомам, одна из которых будет нести группу следующих друг за другом доминантных аллелей, тогда как гомологичная ей – группу рецессивных форм тех же генов. Если хромосома с доминантными генами будет последовательно терять отдельные локусы, то в гетерозиготе будут проявляться рецессивные признаки. Порядок проявления рецессивных признаков указывает на последовательность расположения генов.
При порядке генов AbC в случае делеции, захватывающей ген С, у мух с укороченной хромосомой, потерявшей фрагмент, равный гену С, в фенотипе проявятся аллели с, b и А.
В целом сравнение генетических (кроссинговерных) и цитологических карт показывает их соответствие: чем больший процент кроссинговера разделяет пару генов, тем больше и физическое расстояние между ними. Однако на несоответствие расстояний, определяемых указанными двумя методами, могут влиять два фактора. Во-первых, это области, в которых затруднен или отсутствует кроссинговер (например, в гетерохроматических районах); во-вторых, физическое расстояние будет больше, чем генетическое, если гены разделены зоной «молчащей» ДНК. Расчеты Бриджеса показали, что каждой единице перекреста на карте политенных хромосом слюнных желез D. melanogaster соответствует 4,2 мкм длины политенных хромосом. Эта длина как минимум равна двум-трем средним генам.
Особенности построения генетических карт у прокариот
Для построения генетических карт у прокариот используется явление конъюгации – переноса генетического материала из одной клетки в другую с помощью специальных кольцевых молекул ДНК (плазмид, в частности, с помощью F–плазмиды).
Вероятность переноса определенного гена в клетку–реципиент зависит от его удаления от F–плазмидной ДНК, а точнее, от точки О, в которой начинается репликация F–плазмидной ДНК. Чем больше время конъюгации, тем выше вероятность переноса данного гена. Это дает возможность составить генетическую карту бактерий в минутах конъюгации. Например, у кишечной палочки ген thr (оперон из трех генов, контролирующих биосинтез треонина) находится в нулевой точке (то есть непосредственно рядом с F–плазмидной ДНК), ген lac переносится через 8 мин, ген recE – через 30 мин, ген argR – через 70 мин и т.д.
Более подробно этот вопрос будет рассмотрен при изучении генетики прокариот.
Картирование хромосом человека
Картирование генов основано на составлении групп сцепления. Чем больше известных мутаций и чем меньше число хромосом, тем легче проводить картирование. В этом отношении человек (помимо того, что у него невозможен классический гибридологический анализ) как объект вдвойне неблагоприятен для картирования: известных генов у него сравнительно немного (по крайней мере, так было до конца 70-х годов), а гаплоидное число хромосом достаточно велико – 22 (не считая половых). Это означает, что вероятность того, что два вновь открытых гена окажутся сцепленными, равна 1/22. По этим причинам анализ родословных, который в какой-то мере заменяет гибридологический анализ, дает довольно ограниченную информацию о характере сцепления.
Более перспективными для картирования генов человека оказались методы генетики соматических клеток. Суть одного из них заключается в следующем. Методы клеточной инженерии позволяют объединять различные типы клеток. Слияние клеток, принадлежащих к разным биологическим видам, называется соматической гибридизацией. Сущность соматической гибридизации заключается в получении синтетических культур путем слияния протопластов различных видов организмов. Для слияния клеток используют различные физико-химические и биологические методы. После слияния протопластов образуются многоядерные гетерокариотические клетки. В дальнейшем при слиянии ядер образуются синкариотические клетки, содержащие в ядрах хромосомные наборы разных организмов. При делении таких клеток in vitro образуются гибридные клеточные культуры. В настоящее время получены и культивируются клеточные гибриды «человек × мышь», «человек × крыса» и многие другие.
В гибридных клетках, полученных из разных штаммов разных видов, один из родительских наборов хромосом, как правило, реплицируется быстрее другого. Поэтому последний постепенно теряет хромосомы. Эти процессы интенсивно протекают, например, в клеточных гибридах между мышью и человеком – видами, различающимися по многим биохимическим маркерам. Если при этом следить за каким-либо биохимическим маркером, например ферментом тимидинкиназой, и одновременно проводить цитогенетический контроль, идентифицируя хромосомы в клонах, образующихся после их частичной утраты, то, в конце концов, можно связать исчезновение хромосомы одновременно с биохимическим признаком. Это означает, что ген, кодирующий этот признак, локализован в данной хромосоме. Так, тимидинкиназный ген у человека находится в хромосоме 17.
Некоторая информация о локализации генов может быть получена при анализе числовых и структурных мутаций хромосом, по встречаемости в семьях хромосом с морфологическими вариациями и по учету наследственных признаков. Для этой же цели используют и частичные моносомии, возникающие в результате делеций. Однако в этих случаях необходимо иметь в виду, что иногда изучаемый ген остается в центрическом фрагменте, но его проявление может быть резко ослаблено в результате эффекта положения или каких-либо иных механизмов регуляции (изменение порядка репликации, отрыв промоторного участка и т. д.). В конце 60-х годов был разработан метод гибридизации in situ, в основе которого лежит специфичность комплементарных взаимодействий гена и его копии (мРНК, а также полученной с помощью обратной транскрипции комплементарной ДНК). Разрешающая способность этого метода гораздо выше на политенных хромосомах, чем на митотических хромосомах человека, однако он постоянно совершенствуется.
Генетическое картирование - это картирование, основанное на методах классической генетики - определении групп сцепления, частоты рекомбинации и построении генетических карт, где единицей измерения служат проценты рекомбинации, или сантиморганы (сМ). Цитогенетическое картирование осуществляется с применением методов цитогенетики, когда для локализации каких-либо нуклеотидных последовательностей и определения их взаимного расположения используются цитологические препараты. И, наконец, физическое картирование - это обширная группа методов, позволяющая строить карты генома (обычно их называют физическими) высокого уровня разрешения и определять расстояния между локализуемыми нуклеотидными последовательностями с точностью от нескольких десятков тысяч п.н. до одной нуклеотидной пары.
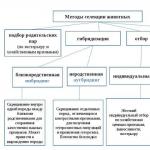
1)Введение
2) Стратегические подходы к картированию геномов
3) Методы картирования геномов млекопитающих
1.1. Генетическое картирование.
1.3. Физическое картирование.
4)Генетическое картирование генома крупного рогатого скота
5) Словарь
6) Список литературы
Работа содержит 1 файл
Огромный вклад в систематизацию и обобщение информации о генетических картах хромосом человека, о локализации и функциях отдельных генов и о структуре генома в целом вносят исследования, проводимые на протяжении последних 30 лет в Университете Джона Хопкинса в Балтиморе под руководством профессора Виктора Мак-Кьюсика. Результатом этих исследований является систематическое, с двухгодичным интервалом между последними шестью публикациями, издание энциклопедий под названием: "Менделевское наследование у человека: каталог генов человека и генетических болезней" ("Mendelian inheritance in men. Catalog of autosomal dominant, autosomal recessive, and X-linked phenotypes"). Эти издания содержат сводные данные обо всех картированных генах человека и связанных с ними наследственных болезнях. Появление и развитие компьютерных баз данных, возможность совмещения различных типов карт позволило перейти на качественно новый уровень анализа картированных последовательностей.
1.2. Цитогенетическое картирование.
Одновременно, в эти же годы, были достигнуты большие успехи в области цитогенетики, связанные с возможностью дифференциального окрашивания метафазных хромосом. Методы дифференциального окрашивания позволяют идентифицировать на препарате как отдельную хромосому, так и любой участок хромосомы, выявляя так называемые бэнды. На метафазных хромосомах малой степени спирализации идентифицируются около 750 бэндов, на прометафазных хромосомах 2500 - 3000. На сегодняшний день разработаны методы многоцветной окраски - multicolor banding (до 25 цветов) интерфазных и метафазных хромосом.
Рис.3Цитогенетический анализ клона гибридных клеток, полученных от слияния эмбриональных стволовых клеток мыши со спленоцитами, с помощью FISH с меченной биотином пробой специфической к Х -хромосоме. Видно, что в кариотипе гибридов присутствует только одна Х -хромосома. Результаты анализа с помощью ПЦР маркеров показали, что эта X-хромосома происходит из спленоцитов (линия мышей DD) (b). Эти результаты свидетельствуют о том, что в гибридных клетках произошло замещение собственной Х -хромосомы клеток НМ-1 (мыши 129/Ola) на Х -хромосому спленоцитов взрослой самки DD
Цитогенетические карты показывают локализацию маркера с точностью до определенной хромосомы, плеча или хромосомного сегмента. Этот тип карт показывает линейный порядок маркеров в хромосоме. По своей разрешающей способности они занимают промежуточное положение между генетическими картами и собственно физическими картами (ряд авторов относит цитогенетическое картирование к методам физического картирования геномов). Цитогенетические карты основываются на расположении генов без определения их вариабельности, тогда как возможность построения генетических карт зависит от наличия аллельного полиморфизма локусов. Построение цитогенетической карты облегчает развитие других типов физических карт, а именно, дает "скелет", на котором помещаются маркеры или контиги перекрывающихся клонов.
Для построения цитогенетических карт млекопитающих в настоящее время используется ряд методов. Определение хромосомной, а в большинстве случаев и субхромосомной локализации маркеров проводят с использованием гибридов соматических клеток между различными видами млекопитающих или непосредственной гибридизации in situ уникальных молекулярных зондов на митотические хромосомы. К основным методам формирования цитогенетических карт относятся также - хромосомный сортинг (проточная цитометрия), микродиссекции и микроклонирование определенных геномных фрагментов и сравнительное генетическое картирование (сравнительная цитогенетика).
В 90-е годы метод гибридизации получил развитие в модификациях: FISH (гибридизация с использованием флюоресцентной метки) и PRINS (метод, сочетающий гибридизацию на метафазных хромосомах специфических праймеров с последующей ПЦР, включающей меченый биотином нуклеотид в продукт амплификации). Этот подход стал основным методом для построения цитогенетических карт.
Разрешение этого метода составляет от 1 до 3 млн.п.н., поэтому гибридизация является методом картирования с низким уровнем разрешения.
Среди цитогенетических методов большое распространение получил метод картирования геномов млекопитающих с помощью гибридов соматических клеток, с которым связан первый прорыв на пути построения карт генома человека и успехи клеточной биологии. В 70-ым годам была разработана техника экспериментального конструирования способных к размножению межвидовых клеточных гибридов. Гибридные клоны получают путем искусственного слияния культивируемых соматических клеток разных видов, в частности клеток человека и различных грызунов: китайского хомячка, мыши, крысы. Гибридные клетки, значительно превосходящие по своим размерам исходные родительские клетки, оказываются способны не только переживать в условиях культивирования, но и размножаться. Однако размножение этих тетраплоидных гибридов, как оказалось, сопровождается утратой хромосом, причем в первую очередь элиминируются хромосомы человека.
Так были получены панели гибридных клеточных клонов, содержащих всего одну или несколько хромосом человека и полный набор хромосом другого вида. Обнаружение белков человека, специфических мРНК или последовательностей ДНК в таких клонах позволяет определить хромосомную принадлежность соответствующих генов. Техника соматической гибридизации явилась одним из наиболее мощных инструментов для нахождения связей между группами сцепления и цитогенетически идентифицируемыми хромосомами и даже их отдельными сегментами. Таким способом удалось локализовать сотни аутосомных генов.
Соматические гибриды спонтанного происхождения были получены в 1960 году, с тех пор развитие работ по гибридам соматических клеток шло по следующим направлениям: 1) поиск безопасных, удобных и эффективных агентов для слияния клеток; 2) создание селективных систем, позволяющих выделять гибриды соматических клеток; 3) изучение феномена сегрегации хромосом, направления и степени, а также возможности направленной сегрегации в соматических гибридах; 4) использование гибридов соматических клеток для создания хромосомных карт млекопитающих.
Для тонкого картирования разработаны два метода: перенос генов, опосредованный хромосомой (CMGT) и перенос генов в процессе слияния облученной клетки-донора с необлученным реципиентом (IFGT, от англ. irradiation and fusion gene transfer). Первый способ предполагает инкубацию очищенных митотических хромосом с клетками реципиента в присутствии фосфата кальция. При этом происходит встраивание фрагментов донорных хромосом в хромосомы клетки-реципиента. Для идентификации гибридов, содержащих нужные фрагменты ДНК донора, применяют соответствующие методы селекции.
Наиболее широко распространенный пример такого подхода - НАТ-селекция (от англ. hypoxanthine, aminopterin, thymidine) . В присутствии аминоптерина (или сходного с ним метатрексата) ингибируется синтез новых предшественников ДНК. Клетки, лишенные фермента тимидинкиназы (ТК), не могут утилизировать экзогенный тимидин и гибнут в присутствии аминоптерина. Аналогично, клетки, лишенные гипоксантин- фосфорибозилтрансферазы (HPRT), не могут усваивать гипоксантин и также, нежизнеспособны в присутствии аминоптерина.
К сожалению, встроенные фрагменты хромосом зачастую претерпевают реорганизацию, кроме того, есть достоверные данные о предпочтительном проникновении в клетку последовательностей из центромерных областей. Эти недостатки не позволяют использовать CMGT для тотального картирования, хотя данный метод весьма эффективен для обогащения специфическими фрагментами хромосом - составной части стратегии клонирования, называемой "обратной генетикой".
1.3. Физическое картирование.
В отличие от генетических карт, построенных на основе групп сцепления и дающих статистические расстояния между ДНК-маркерами и генами, физическое картирование позволяет определять физические расстояния между маркерами в каждой хромосоме.К методам физического картирования относят рестрикционное картирование, RH-картирование, клонирование в YAC (от англ. yeast artificial chromosome), BAC (от англ. bacterial artificial chromosome), космидах, плазмидах и других векторах и контиг-картирование на их основе, а также секвенирование ДНК.
Рис.4 Генетическая карта норки содержит 85 генов, 82 из которых картированы в лаборатории; для 18 генов установлена их региональная локализация, для 8 показан их порядок, а 7 генов были отнесены к группам сцепления хромосом 7 и 12. Рядом с идиограммами хромосом норки приведены данные по ZOO-FISH. Видно, что в геноме норки существуют крупные районы хромосом, гомeологичные хромосомным районам человека
Использование искусственных хромосом создает основу для проведения физического картирования как на хромосомном, так и на субхромосомном уровне.
Основой физического картирования генома является построение физических карт, т.е. определение порядка расположения физических маркеров вдоль молекулы ДНК. В качестве физических маркеров могут выступать сами гены, анонимные фрагменты ДНК (D-сегменты), точки расщепления ДНК рестриктазами и т. п.
Однако при развитии работ по физическому картированию геномов млекопитающих исследователи столкнулись с трудностями при совмещении данных по картированию. Для преодоления этой проблемы в 1989 г. было предложено стандартизовать все обозначения меченных последовательностей ДНК в геноме, включая все типы картированных последовательностей, будь то просто картированный сегмент ДНК с неизвестной функцией (D-сегменты), последовательность с необычными сайтами рестрикции, проба, выявляющая полиморфизм, последовательность, гибридизующаяся с определенным "бэндом" при гибридизации или STS-маркеры (от англ. "sequenсed tagged site").
Основной особенностью STS-маркеров, а также и основным требованием к ним, является их уникальность в геноме. Эти маркеры облегчают перевод различной информации по картированию на единый "язык" STS для анализа и хранения генетической и молекулярной информации, кроме того, оптимизируется процесс насыщения физической карты генома человека маркерами. Созданные на сегодняшний день электронные молекулярно-генетические базы данных значительно облегчают поиск информации по картированию и секвенированию последовательностей любого изучаемого вида, позволяют оценивать степень гомологии и эволюционной связи между геномами различных видов. В настоящее время одно из основных направлений в данной области - это перевод всех STS-маркеров на основу ПЦР для более удобного использования. К исходному секвенированному участку ДНК подбирается пара праймеров, как правило, с учетом того, чтобы расстояние между ними не превышало 1 т.п.н. для удобства проведения ПЦР. Если участок и праймеры к нему не имеют аналогов в базе данных, содержащих секвенированные на данный момент последовательности ДНК, то праймеры синтезируют и с ними проводят ПЦР, где в качестве матрицы используют тотальную ДНК генома. Если полученный амплификат представляет собой единственный фрагмент на геном, то эта последовательность может считаться уникальной и может быть использована как STS. Вся информация, касающаяся каждого маркера, хранится в базах данных (NCBI, EMBL, DDBJ, GDB и др.). Она включает в себя сведения о нуклеотидной последовательности праймеров, условия реакции ПЦР, длину продукта амплификации и его нуклеотидную последовательность. Одним из результатов международной программы "Геном человека" явилось создание такого количества STS-маркеров, которое позволило покрыть ими весь геном человека через каждые 50 т.п.н. вдоль каждой хромосомы (на сегодняшний день в базах данных зарегистрировано более 60000 STS-маркеров).
Совмещение карт возможно благодаря локализации многих клонированных генетических маркеров на физических картах с помощью гибридизации, то есть привязке к определенным хромосомным сегментам. Эти локусы служат для взаимосвязи генетических карт с физическими и дают возможность выяснения соотношения между генетическими расстояниями в сантиморганах и физическими расстояниями, выраженными в тысячах пар нуклеотидов.
Рис.6 Результаты экспериментов по тестированию плюрипотентности внутривидовых гибридных клеток от слияния эмбриональных стволовых (ЭС) клеток (линия HM-1 получена от мыши линии 129/Ola, справа) со спленоцитами взрослой самки мыши (линия DD слева). При введении гибридных клеток в полость бластоцисты (реципиентная линия C57BL/J, слева) получено 5 химерных мышей, одна из которых представлена на рисунке в центре. Пятна желтой окраски появились в результате размножения гибридных клеток и их участия в формировании волосяного покрова химеры. Результаты биохимического анализа (маркер Gpi-1, кодирующий глюкозо-6-фосфат изомеразу) химер показали, что гибридные клетки внесли вклад в формирование большинства органов и тканей
4) Генетическое картирование генома крупного рогатого скота (КРС)
Отечественным ученым принадлежит приоритет в картировании генов сельскохозяйственных животных: в 1926 г. А. С. Серебровский и Е. Т. Васина-Попова описали расположение генов в половой хромосоме курицы. Успешно проводившиеся А. С. Серебровским исследования по генетическому картированию были прерваны и до сих пор в нашей стране на материале сельскохозяйственных животных не возобновлены. В то же время за рубежом интерес к построению генетических карт лабораторных и домашних животных все более возрастает. Иллюстрацией сказанного может служить то, что на исследования генома собаки с целью построения генетической карты этого вида в США ассигновано на 5 лет 750тыс. долларов. Целью этого проекта является нанесение на генетическую карту до 400 маркеров, что позволит в частности, определить локализацию генов тех или иных наследственных болезней.
Естественно, что особое внимание уделяется картированию геномов важнейших видов сельскохозяйственных животных. Созданный в 1990 г. проект их генетическое картирование должен был получить в 1991 г. финансирование в размере 10 мил. долларов в год. Первый объект планируемых исследований – крупный рогатый скот, в дальнейшем предполагается изучить геном овец, коз, свиней, лошадей, кур. В настоящем обзоре мы рассмотрим современное состояние исследований, посвященных построению генетических карт генома крупного рогатого скота (КРС) – биологического вида Bos taurus.
При картировании генов крупного рогатого скота исследуются три метода. Первый из них – популяционно- генеалогический анализ. Именно с помощью этого метода был обнаружен первый случай сцепления генов у крупного рогатого скота (тесное сцепление генов казеинов молока). КРС относится к числу малоплодных и медленно размножающихся животных, поэтому стандартный генетический анализ в этой же ферме, в которой он используется для картирования геномов лабораторных животных, в данном случае невозможен. Применяемый подход заимствован из арсенала генетики человека и состоит и состоит в определении достоверности отклонения наблюдаемой частоты рекомбинации между двумя генами от 0,5 т. е. определяется наличие сцепления. Соответствующий статистический тест носит название lod-score-test. При использовании этого теста для каждой семьи, в которой обнаружено расщепление по анализируемым генам вычисляется величина z: